重要なお知らせ
ME/CFS患者を対象とした神経炎症を調べるPET検査の被験者の募集
平成28年11月に採択された、国立研究開発法人日本医療研究開発機構(AMED)「創薬基盤推進研究事業」「ポジトロンCTで脳内炎症が確認された患者に対するミクログリア活性化抑制薬の有効性検証」(代表研究者:渡辺恭良)の被験者の募集をしております。 詳しくはこちらの資料(PDFファイル3)をご覧ください。
お知らせ
○2018.03.30 重要なお知らせを更新いたしました
○平成25-27年度 厚生労働科学研究費補助金(障害者対策総合研究事業)(神経・筋疾患分野)「慢性疲労症候群の病因病態の解明と画期的診断・治療法の開発」研究班(代表研究者 倉恒弘彦)
平成25-27年度研究成果報告書(総括報告)を公開いたしました
○平成27-29年度 日本医療研究開発機構(AMED)障害者対策総合研究開発事業 神経・筋疾患分野「慢性疲労症候群に対する治療法の開発と治療ガイドラインの作成」研究班
平成27年度研究成果報告書(総括報告)を公開いたしました
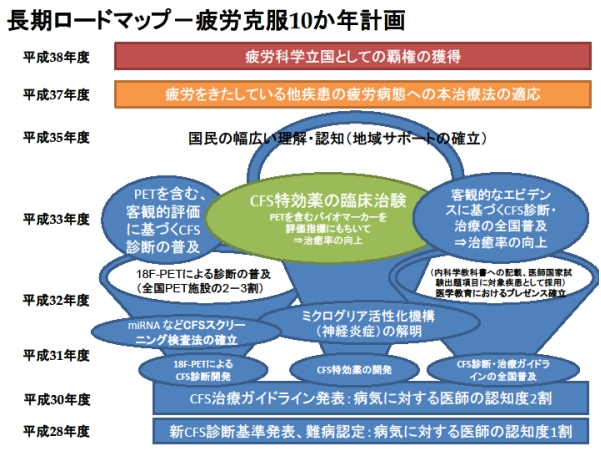
平成28年度研究
慢性疲労症候群(CFS)に有効な治療法は未だ確立されておらず、CFS患者の1/4は長期にわたりほとんど回復がみられず、日中も臥床して生活し、生活介護も必要であることが多い。
そこで、本研究では日本においてCFS治療を実践している医療機関におけるCFS患者の治療実態や患者の予後調査を実施し、日本におけるCFS診療実態を明らかにする。
また、CFS治療として有用性が期待されているL-カルニチン、漢方薬治療、認知行動療法、向精神薬治療、抗神経炎症薬剤などについての臨床試験を継続し、CFS治療法の有効性を検証する。
さらに、平成28年度よりはCFS患者に対する和温療法の治療効果の検証に着手する。 また、世界中で行われているCFS治療法について科学的根拠に基づいた評価を継続し、EBM(evidence-based medicine)に基づいた日本におけるCFS治療ガイドラインの作成を作成する。
平成28年度研究実施体制
代表研究者:
倉恒弘彦(関西福祉科学大学、大阪市立大学、東京大学)
分担研究者:
稲葉雅章(大阪市立大学)
福田早苗(関西福祉科学大学、大阪市立大学)
伴信太郎(名古屋大学)
吉原一文(九州大学)
松本美富士(東京医科大学)
遊道和雄(聖マリアンナ医科大学)
鄭 忠和(獨協医科大学、和温療法研究所)
御挨拶
日本医療研究開発機構(AMED)障害者対策総合研究開発事業 代表研究者 倉恒 弘彦 |
|
慢性疲労症候群(chronic fatigue syndrome: CFS)とは、これまで健康に生活していた人がある日突然原因不明の激しい全身倦怠感に襲われ、それ以降強度の疲労感と共に、微熱、頭痛、筋肉痛、脱力感や、思考力の障害、抑うつ等の精神神経症状などが長期にわたって続くため、健全な社会生活が送れなくなるという病気です。1988年、米国疾病対策センター(CDC)よりCFSの報告が行われて以降、アメリカだけでなくカナダ、イギリス、ドイツ、スウェーデン、オーストラリアなど世界中の国々においてCFS症例の存在が報告され、その病因・病態の解明や診断、治療法の開発が進められています。
我が国におきましても、1991年より旧厚生省にCFS研究班(主任研究者:木谷照夫)が発足し、6年間(1991年4月~1997年3月)に渡って病因・病態の解明、治療法の開発に向けた臨床研究が行われています。1999年、「疲労の実態調査と健康づくりのための疲労回復手法に関する研究」の中で慢性疲労の実態調査(対象:一般住民4,000名、有効回答者3,015名(75.4%))を行いましたところ、国民の35.6%が慢性的な疲労を自覚しており、生活に何らかの支障をきたしている方が約5.2%存在することが明らかになりました。なかでも重篤な慢性疲労状態であるCFSの診断基準を満たす方も0.3%確認されていまして、この数字を単純に現在の日本人口1億2千万人に当てはめてみますと、我が国ではCFS患者は実に約36万人も存在することとなります。
2012年、13年ぶりに同一地区の疫学調査(対象:一般住民2,000名、有効回答者1,149名(57.5%))を行った結果でも、6か月以上の慢性的な疲労を自覚している方が38.7%おられ、全身倦怠感のため月に数日は社会生活や労働ができず、自宅にて休息が必要であると答えた方が2.1%認められました。さらに、2012年に改定したCFS臨床診断基準を満たす方が0.1%、1999年のCFS診断基準を満たす可能性がある方が0.2%認められており、CFSは21世紀の社会において対応すべき疾病の1つであることは間違いありません。
しかし、日本を含めて世界中で用いられてきたCFS診断基準は問診票を用いた症状診断と臨床検査による除外診断を組み合わせたもので、保険診療で認められている一般臨床検査には異常が認められませんので、CFS患者が医療機関を受診しても十分な対応を受けることが難しい状況にあります。その上、現在診療上用いられているCFSという病名は疲労が単に長く続いていることを示すような印象を与えるため、誰もが日常生活において自覚している疲れを強く訴えているに過ぎないと思われがちであり、誤解や偏見を受ける要因の1つとなっています。
ここで重要なことは、CFSは決して詐病のような病態ではないことが判明していることです。CFS患者の病因・病態には脳機能異常が深くかかわっており、特に重症のCFS患者では中脳や視床における炎症が存在することがポジトロンCT(PET)などの特殊検査装置を用いた検査で分かってきました(2011年度報告書)。この脳における炎症は、通常の頭部CT検査やMRI検査ではみつけることができません。また、種々の免疫機能、自律神経機能、睡眠覚醒リズム、酸化ストレス、内分泌系評価、ウイルス学的検査などの成績においても多くの異常がみられており、CFSは決して自覚している疲れを強く訴えているような病態ではないことが確認されています。
我々は、日本におけるCFS患者の実態を明らかにするために、2012年度にCFS診療を行っている医療機関の協力を得てCFS患者470名(平均年齢:40.8±10.5歳、男性161名、女性309名)の調査を行いましたところ、日常生活のかなり多くの部分が疾患により阻害されている実態が明らかになってきました。CFSに対する治療を受けていても回復がみられない患者が半数近くおられ、PS7(身の回りのことはでき、介助も不要であるが、通常の社会生活や軽労働は不可能である)以上の状態が続いている患者も1/4近く認められています。このような重症のCFS患者の多くは、家族の支えにより何とか生活をしているのが実態であり、最低限の国民生活を営むためには社会的な支援が必要であると思われます。
そこで、平成27年度に新たに採択された日本医療研究開発機構(AMED)障害者対策総合研究開発事業 神経・筋疾患分野「慢性疲労症候群に対する治療法の開発と治療ガイドラインの作成」研究班(代表研究者:倉恒弘彦)では、日本においてCFS治療を実践してきている医療機関における治療実態を調査するともに、CFSの病因・病態に即した治療法について有効性を検討することと致しました。さらに、世界中で行われているCFS治療について科学的根拠に基づいた評価を行い、日本におけるCFS治療ガイドラインを平成30年3月に発表する予定です。
2015年2月、全米アカデミーの1つである米国医学研究所は、世界中で報告されてきたCFSや筋痛性脳脊髄炎(myalgic encephalomyelitis:ME)に関する9112の論文を2年間かけてレビューし、CFS/MEに対する新たな疾病概念として全身性労作不耐症(systemic exertion intolerance disease:SEID)を提唱しました。この提言では、「CFS/MEは、罹患した患者の健康や活動に深刻な制限をもたらす全身性の重篤な慢性の複雑な疾患であり、重篤な場合には患者の生活そのものを破壊する深刻な病態である」と明記した上で、中核となる症状を整理したSEIDの臨床診断基準の活用を勧めています。
さらに、米国医学研究所は全米の臨床医に対して、SEIDが重篤な全身疾患であることを理解して、診断・治療に取り組むように提言するとともに、今後5年間以内に科学的根拠に基づく診断基準を作成する必要があると勧告しています。CFS/MEに対して科学的根拠に基づく診断基準を作成する作業は、まさに日本の本研究班が世界に先駆けて着手してきたことであり、本研究の重要性を追認するものであると言えます。
2013-2015年度に実施しました厚生労働科学研究費補助金(障害者対策総合研究事業)(神経・筋疾患分野)「慢性疲労症候群の病因病態の解明と画期的診断・治療法の開発」研究班では、診断基準検討委員会(グループリーダー:伴 信太郎(名古屋大学))を設置し、本邦において用いるCFS診断基準について検討を重ねた結果、CFS臨床診断基準はプライマリ・ケアを担っている医師が医療現場で用いる診断基準で、簡便性、利便性が求められるのに対して、研究用CFS診断基準は病因・病態の解明を目指した研究機関が対象を明確にする診断基準であり、統一性・厳格性が求められることより、両者は区別して用いることが望ましいという結論に至り、それぞれの診断基準についての考えを明確に致しました。
また、CFSの呼び名(病名)についても診断基準検討委員会において1年間かけて検討した結果、CFSというこれまでの病名は疲労という誰もが日常生活で経験している症状を病名として用いていることにより誤解や偏見を受ける可能性が高く、この問題点を早急に解消する必要性が指摘され、世界中の多くの医学会誌で用いられているME/CFS(筋痛性脳脊髄炎/慢性疲労症候群)を用いることと致しました。以下に診断基準検討委員会がとりまとめましたME/CFS臨床診断基準(案)、ME/CFSを難病等の認定に向けて評価する客観的指標(案)、研究用ME/CFS診断基準(案)を紹介していますので、ご参照ください。慢性疲労症候群(CFS)診断基準の改訂について
厚生労働科学研究費補助金(障害者対策総合研究事業)(神経・筋疾患分野)「慢性疲労症候群の病因病態の解明と画期的診断・治療法の開発」研究班
臨床診断基準検討委員会
伴信太郎、松本美富士、田島世貴、吉原一文、福田早苗、倉恒弘彦
全米アカデミーの1つである米国医学研究所(Institute of Medicine: IOM)は、世界中で報告されてきた慢性疲労症候群(chronic fatigue syndrome:CFS)や筋痛性脳脊髄炎(myalgic encephalomyelitis:ME)に関する9112の論文を2年間かけてレビューし、2015年2月、CFS/MEに対する新たな疾病概念として全身性労作不耐症(systemic exertion intolerance disease:SEID)を提唱した。
この提言では、「CFS/MEは、罹患した患者の健康や活動に深刻な制限をもたらす全身性の重篤な慢性の複雑な疾患であり、重篤な場合には患者の生活そのものを破壊する深刻な病態である」と明記した上で、中核となる症状を整理したSEIDの臨床診断基準の活用を勧めている。
さらに、IOMは全米の臨床医に対して、SEIDが重篤な全身疾患であることを理解して、診断・治療に取り組むように提言するとともに、今後5年以内に科学的根拠に基づく診断基準を作成する必要があると勧告している。
CFS/MEに対して科学的根拠に基づく診断基準を作成する作業は、まさに日本の本研究班が世界に先駆けて着手してきたことであり、本研究の重要性を追認するものである。今後は、世界中の臨床医や研究者はSEID診断基準を満たす病態に対して病因・病態の解明に向けた臨床研究に取り組むことが予想される。
そこで、本研究班でも診断基準検討委員会において、本邦で用いるCFS診断基準について検討を重ねた結果、CFS臨床診断基準はプライマリ・ケアを担っている医師が医療現場で用いる診断基準であり、簡便性、利便性が求められるのに対して、研究用CFS診断基準は病因・病態の解明を目指した研究機関が対象を明確にする診断基準であり、統一性・厳格性が求められることより、両者を同一の基準として用いる必要はないという結論に至った。
2015年2月にIOM が発表したSEID診断基準については、プライマリ・ケアを担っている医師が医療現場で用いる診断基準としての簡便性、利便性が認められる一方で、診断基準としての特異度が低く、アメリカ疾病予防管理センター(Centers for Disease Control and Prevention:CDC)のCFS診断基準(Fukuda基準、1994年)に比して有病率は2.8倍になるという指摘や、除外基準が記載されていないため、多くの精神疾患がSEID基準に含まれてしまうという報告など、いくつかの問題点も指摘されている。そこで、診断基準検討委員会としては以下の4点を修正して本邦において用いるCFS臨床診断基準とすることとした。
(ア) ME/CFS診断に必要な最低限の検査を明記
(イ) 鑑別すべき主な疾患・病態を記載
(ウ) 共存を認める疾患・病態を記載
(エ) PS(performance status)によるQOL評価を採用 (医師が判断、判断の具体例も記載)
また、CFSの呼び名(病名)についても診断基準検討委員会において1年間かけて検討した結果、CFSというこれまでの病名は疲労という誰もが日常生活で経験している症状を病名として用いていることにより誤解や偏見を受ける可能性が高く、この問題点を早急に解消する必要性が指摘され、世界中の多くの医学会誌で用いられているME/CFS(筋痛性脳脊髄炎/慢性疲労症候群)を用いることとなった。
尚、今回の改定ではプライマリ・ケアを担っている医師が医療現場で用いる診断基準としての簡便性、利便性を考えてSEID基準を修正した臨床診断基準を提唱したことより、病名はME/CFS/SEIDとするべきであるという考えも示されたが、あまりに長い病名を医療現場で用いることは好ましくないという意見が多く、正式な診断名はME/CFS(筋痛性脳脊髄炎/慢性疲労症候群)とし、略語としてME/CFS/SEIDを用いることも認めることとした。
筋痛性脳脊髄炎/慢性疲労症候群(ME/CFS)臨床診断基準(案) (2016年3月改訂)
Ⅰ.6ヵ月以上持続ないし再発を繰り返す以下の所見を認める
(医師が判断し、診断に用いた評価期間の50%以上で認めること)
1. 強い倦怠感を伴う日常活動能力の低下*
2. 活動後の強い疲労・倦怠感**
3. 睡眠障害、熟睡感のない睡眠
4. 下記の(ア)または(イ)
(ア)認知機能の障害
(イ)起立性調節障害
Ⅱ.別表1-1に記載されている最低限の検査を実施し、別表1-2に記載された疾病を鑑別する
(別表1-3に記載された疾病・病態は共存として認める)
*:病前の職業、学業、社会生活、個人的活動と比較して判断する。体質的(例:小さいころから虚弱であった)というものではなく、明らかに新らたに発生した状態である。過労によるものではなく、休息によっても改善しない. 別表2に記載された「PS(performance status)による疲労・倦怠の程度」を医師が判断し、PS 3以上の状態であること。
**:活動とは、身体活動のみならず精神的、知的、体位変換などの様々なストレスを含む。
別表1-1. ME/CFS診断に必要な最低限の臨床検査
(1) 尿検査(試験紙法)
(2) 便潜血反応(ヒトヘモグロビン)
(3) 血液一般検査(WBC、Hb、Ht、RBC、血小板、末梢血液像)
(4) CRP、赤沈
(5) 血液生化学(TP、蛋白分画、TC、TG、AST、ALT、LD、γ-GT、BUN、Cr、尿酸、 血清電解質、血糖)
(6) 甲状腺検査(TSH)、リウマトイド因子、抗核抗体
(7) 心電図
(8) 胸部単純X線撮影
別表1-2. 鑑別すべき主な疾患・病態
(1) 臓器不全:(例;肺気腫、肝硬変、心不全、慢性腎不全など)
(2) 慢性感染症:(例;AIDS、B型肝炎、C型肝炎など)
(3) 膠原病・リウマチ性、および慢性炎症性疾患:
(例;SLE、RA、Sjögren症候群、炎症性腸疾患、慢性膵炎など)
(4) 神経系疾患:
(例;多発性硬化症、神経筋疾患、てんかん、あるいは疲労感を惹き起こすような薬剤を持続的に服用する疾患、後遺症をもつ 頭部外傷など)
(5) 系統的治療を必要とする疾患:(例;臓器・骨髄移植、がん化学療法、 脳・胸部・腹部・骨盤への放射線治療など)
(6) 内分泌・代謝疾患:(例;糖尿病、甲状腺疾患、下垂体機能低下症、副腎不全、など)
(7) 原発性睡眠障害:(例;睡眠時無呼吸症候群、ナルコレプシーなど)
(8) 精神疾患:(例;双極性障害、統合失調症、精神病性うつ病、薬物乱用・依存症など)
別表1-3. 共存を認める疾患・病態
(1) 機能性身体症候群(Functional Somatic Syndrome: FSS)に含まれる病態線維筋痛症、過敏性腸症候群、顎関節症、化学物質過敏症、間質性膀胱炎、機能性胃腸症、月経前症候群、片頭痛など
(2) 身体表現性障害 (DSP-IV)、身体症状症および関連症群(DSM-5)、気分障害(双極性障害、精神病性うつ病を除く)
(3)その他の疾患・病態
起立性調節障害 (OD):POTS(体位性頻脈症候;postural tachycardia syndrome)を含む若年者の不登校
(4)合併疾患・病態
脳脊髄液減少症、下肢静止不能症候群(RLS)
別表2. PS(performance status)による疲労・倦怠の程度(PSは医師が判断する)
0:倦怠感がなく平常の社会生活ができ、制限を受けることなく行動できる
1:通常の社会生活ができ、労働も可能であるが、疲労を感ずるときがしばしばある
2:通常の社会生活ができ、労働も可能であるが、全身倦怠感のため、しばしば休息が必要である
3:全身倦怠感のため、月に数日は社会生活や労働ができず、自宅にて休息が必要である*1
4:全身倦怠感のため、週に数日は社会生活や労働ができず、自宅にて休息が必要である*2
5:通常の社会生活や労働は困難である。軽労働は可能であるが、週のうち数日は自宅にて休息が必要である*3
6:調子の良い日には軽労働は可能であるが、週のうち50%以上は自宅にて休息している
7:身の回りのことはでき、介助も不要であるが、通常の社会生活や軽労働は不可能である*4
8:身の回りのある程度のことはできるが、しばしば介助がいり、日中の50%以上は就床している*5
9:身の回りのこともできず、常に介助がいり、終日就床を必要としている
疲労・倦怠感の具体例(PSの説明)
*1 社会生活や労働ができない「月に数日」には、土日や祭日などの休日は含まない。また、労働時間の短縮など明らかな勤務制限が必要な状態を含む。
*2 健康であれば週5日の勤務を希望しているのに対して、それ以下の日数しかフルタイムの勤務ができない状態。半日勤務などの場合は、週5日の勤務でも該当する。
*3 フルタイムの勤務は全くできない状態。
ここに書かれている「軽労働」とは、数時間程度の事務作業などの身体的負担の軽い労働を意味しており、身の回りの作業ではない。
*4 1日中、ほとんど自宅にて生活をしている状態。収益につながるような短時間のアルバイトなどは全くできない。ここでの介助とは、入浴、食事摂取、調理、排泄、移動、衣服の着脱などの基本的な生活に対するものをいう。
*5 外出は困難で、自宅にて生活をしている状態。日中の50%以上は就床していることが重要。
客観的指標を取り入れたME/CFS診断基準の作成に向けて
厚生労働科学研究費補助金(障害者対策総合研究事業)(神経・筋疾患分野)「慢性疲労症候群の病因病態の解明と画期的診断・治療法の開発」研究班
ME/ CFS診断基準検討委員会
倉恒弘彦、伴信太郎、松本美富士、田島世貴、吉原一文、福田早苗
我々は、1999年に採択された文部科学省の「疲労および疲労感の分子・神経メカニズムとその防御に関する研究」(研究提案者:渡辺恭良、倉恒弘彦)において、「慢性疲労症候群(chronic fatigue syndrome:CFS)は感染症や環境的ストレス(過重労働、精神ストレス、化学物質暴露、紫外線、騒音など)をきっかけに神経系、免疫系、内分泌系の機能異常が惹起された病態であり、NK活性の低下などによりヘルペスウイルスなどの再活性化が惹起され、生体防衛のために産生された種々のサイトカインにより、脳神経系の機能異常や神経障害が引き起こされ、CFS病態に陥る」との仮説を世界に先駆けて提唱し、この仮説の実証に向けた取り組みを進めてきた。
2011年に発表された筋痛性脳脊髄炎(myalgic encephalomyelitis:ME)診断基準(J Intern Med. 2011)においても、「MEは複雑で広範な機能障害を伴う神経系の病態で、細胞のエネルギー代謝やイオン輸送障害などを伴う神経系、免疫系、内分泌系の機能異常を特徴としている」と記載されており、世界中の研究者はほぼ共通の認識に立って病因・病態の解明に取り組んでいると思われる。
しかし、現在のCFSやME診断基準を満たす患者には極めて多様な病態が含まれていることも明らかになっており、病因・病態の解明に向けてはME/ CFS患者の層別解析が極めて重要である。
最近、脳内で炎症がおきると、脳内免疫防御を担っているミクログリア細胞が活性化し、末梢性ベンゾジアゼピン受容体と呼ばれる分子を発現することが明らかとなり、positron emission tomography (PET)を用いて活性型ミクログリアの有無を検査することにより、脳内神経炎症の存在を直接調べることが可能となってきた。
そこで、CFS患者9名と健常者10名を対象として、活性型ミクログリアに発現するtranslocator proteinのリガンドPK11195を用いたPET検査を実施したところ、CFS患者群では左視床、中脳、橋においてPK11195結合が有意に高いことを世界で初めて見出した(図1)。
被験者となられたCFS患者における頭部CT検査やMRI検査では異常がみられておらず、通常の保険診療で異常がみられないCFS患者でも、脳内の神経炎症が存在している可能性が高い。さらに、各自覚症状とPK11195結合の関連がみられる部位を調べたところ、視床、中脳、扁桃体での炎症が強い場合は認知機能障害が強く、帯状回や視床の炎症の強さと頭痛や筋肉痛などの痛みの程度に相関がみられ、海馬での炎症が強いほど抑うつ症状が強いことも判明した(図2)。
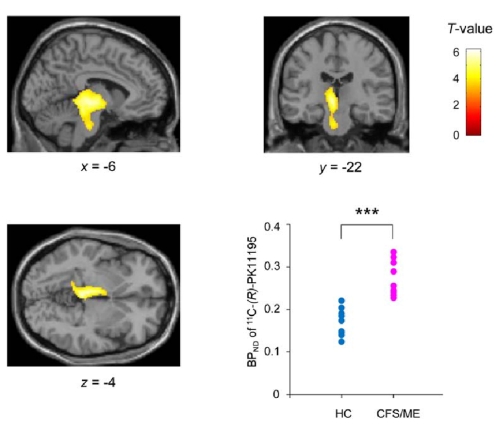
図1.CFS患者群において神経炎症がみられる部位
左上:sagital、右上:coronai、左下:transaxial
右下:健常者とCFS患者における11C-(R)-PK11195のbinding petential(BP)
(Nakatomi Y,J Nucl Med 55(6):945-950,2014より引用)
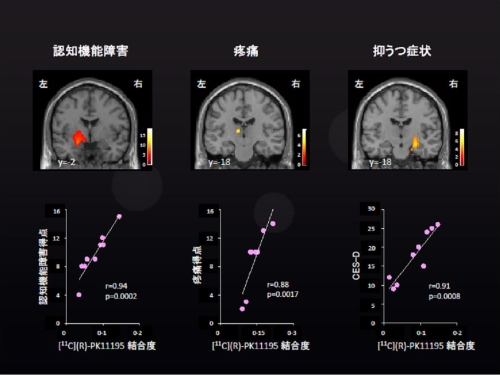
図2.CFS患者における認知機能障害、疼痛、抑うつと神経炎症
上段:症状の程度と神経炎症が相関している部位
下段:各症状得点と11C-(R)-PK11195結合度の関連
(Nakatomi Y,J Nucl Med 55(6):945-950,2014を一部改編)
したがって、CFSは単に脳機能の変調のような機能的な病態にとどまらず、重症例ではミクログリアの活性化で示される器質的な病態である可能性が考えられる。この発見は、米国におけるCFS研究の第1人者Komaroff教授(Harvard大学)が発表した2014年におけるME/CFSに関する世界10大発見の1つとして大きく取り上げられており、米国やヨーロッパのCFS患者を対象とした臨床試験が始まっている。
PET検査によりME/ CFSにおけるミクログリアの活性化(神経炎症)を客観的に診断することができるようになれば、ME/CFS診療における大きな課題が改善し、特異的な治療法の開発にも寄与する可能性は高い。
しかし、現在の神経炎症の診断に用いられているPK11195はポジトロン核種11Cを用いているため、半減期が20分と極めて短いため、日本で稼働している一般のPET検査施設では実施は難しく、現時点では客観的診断基準における評価項目の1つに採用することはできなかった。この課題に対しては、11Cよりも半減期が長く癌検診などでFDGとして用いられている18Fを用いてミクログリアの活性化を評価することができるPETプローブ開発を行えば、一般診療においてME/ CFSにおける神経炎症の有無を評価することが可能となることより、H28年度AMED障害者対策総合研究開発事業において、「イメージングと新規バイオマーカーを用いた慢性疲労症候群の客観的診断法の開発」(代表研究者:渡邊恭良)として研究開発を進めることとなった。
また、平成25~27年度に実施したCFS班研究において、CFSでは、①酸化ストレス値(d-ROMs)の上昇、抗酸化力値(BAP)の低下(酸化ストレス解析)、②TCA回路におけるクエン酸⇒イソクエン酸への移行が半減、尿素回路においてオルニチン⇒シトルリンへの移行が低下(メタボローム解析)(特許申請中)、③血中ミトコンドリアDNAの上昇、④血液中細胞外分泌顆粒(Extracellular vesicle)の上昇(特許申請中)など、いくつかのスクリーニング検査として有用であると思われるバイオマーカーが明らかになった。
しかし、プライマリ・ケアを担っている医療機関がME/CFSを難病等の認定に向けて評価する客観的指標として採用するためには、CFS病態に対する感度/特異度とともに、一般の臨床検査施設で実施可能な検査項目である必要性が指摘され、現時点では診断基準の評価項目としての採用は見送ることとなった。
そこで、プライマリ・ケアを担っている医師が難病等の認定に際しては、上述のME/CFS臨床診断基準の判定を行うとともに、客観的評価としてME/CFS臨床診断基準の主たる臨床症状(強い倦怠感を伴う日常活動能力の低下)を客観的に裏付けることができる24時間活動量評価(アクティグラフ(AMI社)、ライフ顕微鏡((株)日立製作所)などの加速度評価装置を用いた判定)を実施することを推奨することとした。
健常者72名(年齢 40.3±7.5歳、男21名、女51名)とPS5以上のCFS患者72名(年齢 41.3±7.5歳、男15名、女57名)に対して実施した24時間活動量評価(0.01G以上の加速度変化が1分間に何回計測されるか示すZC値を用いて評価)では、感度91.7%、特異度90.3%(cut off値:130.3)(図3)と極めて高い感度、特異度が認められ、健常者において認められる慢性疲労(通常の日常生活や社会生活が可能な状態)とは区別が可能であることが確認されている。
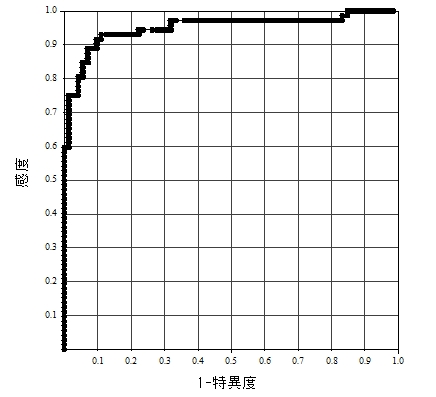
図3 ROC曲線による24時間活動量(ZC値)
健常者72名とCFS患者72名(ps5以上)
感度:91.7%、特異度:90.3%
cut off値:130.3
次に、日本において病因・病態の解明を目指した研究機関が対象を明確にする研究用CFS診断基準としては、臨床診断基準についてはグローバルスタンダードの観点から世界で主に用いられている以下の診断基準をチェックすることを推奨することとした。
一般診療において用いる比較的簡便な診断基準
1.SEID診断基準(2015)
IOM (Institute of Medicine). Beyond myalgic encephalomyelitis/chronic fatigue syndrome: Redefining an illness. Washington DC: The National Academies Press (US); 2015 Feb.
2.日本ME/CFS臨床診断基準(2016)
伴信太郎ほか. 厚生労働科学研究費補助金(障害者対策総合研究事業)(神経・筋疾患分野)「慢性疲労症候群の病因病態の解明と画期的診断・治療法の開発」平成27年度報告書2016.
病因・病態の解明などにおいて、対象症例を明確にするために用いる診断基準
3. CFS診断基準(CDC基準、1994年)
Fukuda KF, Straus SE, Hickie I, et al. The chronic fatigue syndrome: a comprehensive approach to its definition and study. Ann Intern Med 1994;121:953-9.
4. カナダME/CFS診断基準(2003)
Carruthers BM, Jain AK, DeMeirleir KL, et al. Myalgic Encephalomyelitis/chronic fatigue syndrome: Clinical working case definition, diagnostic and treatments protocols. Journal of Chronic Fatigue Syndrome. 2003;11:7–115.
5. ME診断基準(2011)
Carruthers BM1, van de Sande MI, De Meirleir KL, et al. Myalgic encephalomyelitis: International Consensus Criteria. J Intern Med. 2011;270(4):327-38.
また、層別解析に活用する評価項目として、本研究班にて明らかになってきたバイオマーカーに加えて、世界中の2か所以上の異なった研究機関から学術論文として発表されている神経系、免疫系、内分泌系の異常を取り上げて、ME/CFSを層別解析できる評価項目として表1-表3にまとめた。
2016年度よりNational Institutes of Health(NIH、米国)はNIHクリニカルセンターを活用してME/CFSの病因・病態の解明、診断法の確立を目指した臨床試験を開始することを発表しているが、ここで検討するものは感染後に発病し、発病後6か月から5年以内の患者であり、かつCFS診断基準(CDC基準、1994年)とカナダME/CFS診断基準(2003)をともに満たすことを条件としている。
今後、ME/CFSの病因・病態に即したバイオマーカーが明らかとなり、科学的根拠に基づく診断基準によりME/CFSが診断される日は近いと確信している。
表1 脳神経系の客観的所見
脳画像解析
MRI 灰白質、白質、基底核、脳幹部の異常など
fMRI 脳機能異常、作業負荷に対する過剰反応など
SPECT(Single-photon emission computed tomography) 局所脳血流の異常
PET(positron emission tomography) 局所脳血流、FDG、セロトニン輸送体、セロトニン受容体、アセチルコリン受容体、アセチルカルニチンの取り込みなどの異常、ミクログリアの活性化
作業負荷に対する反応異常など
自律神経系
心電計、脈波検査による心拍変動解析
安静時:自律神経機能異常、交感神経系の過緊張、副交感神経活動の低下など
シェロングテスト・Head-up tilt(HUT)(起立試験):
心拍変動及び血圧の変化→起立性調節障害の存在
表2 内分泌・代謝系の客観的所見
内分泌系の異常
安静時の異常…HPAフィードバック異常、CRA(Cortisol Awaking resting)、DHEA-S、ACTH、Glucocorticoid receptor数、コルチゾール代謝物(尿)、Growth hormone、等
サーカディアンリズム異常
負荷時(CRH負荷・Dex/CRF負荷試験、ACTH投与、インシュリン負荷など)の異常…上記安静時のマーカー等
運動負荷後の異常…上記安静時のマーカー等
エネルギー代謝系の異常
安静時の異常
Liqid peroxidation、CoQ10、Cortical glutatjione GSH、malondialdehyde(MDA)、production of iNOS、production of COX-2、urinary excretion of 8-OHdG等
その他代謝異常
カルニチンの異常…アシルカルニチン等
ミトコンドリアの異常…ATP、Mitochondrial content(酵素等)
運動負荷時の異常…上記安静時のマーカー等
表3 免疫系、遺伝子関連の客観的所見
自然免疫の異常
皮膚・粘膜、補体、NK細胞、好中球、マクロファージ、Danger-associated molecular pattern(DAMP)などの異常
獲得免疫の異常
B細胞の異常
B細胞の数・機能異常、免疫グロブリン異常、自己抗体など
T細胞の異常
T細胞の数・機能異常など
樹枝状細胞の異常
樹枝状細胞の数・機能異常など
サイトカインの異常
血液中、培養上清中の異常(インターロイキン(IL-1β、IL-6、IL-7、IL-8、IL-10など)、インターフェロントランスフォーミング成長因子など)
遺伝子関連の検査異常
遺伝子多型の存在(Single Nucleotide Polymorphism、microsatellite polymorphism)
細菌、ウイルスなどのDNAの検出
DNAマイクロアレイ検査などによる遺伝子発現量の変化
慢性感染症、ウイルス再活性化を示唆する検査異常
EBウイルス、ヘルペスVI型ウイルス、コクサッキーBウイルス、単純ヘルペスウイルス、帯状ヘルペスウイルス、ボルナ病ウイルス、マイコプラズムリケッチアなど
その他、免疫関連の異常を客観的に支持する所見
血液中37-kDa RNase Lの存在など
運動、労作に伴う免疫系変化(mRNA、サイトカイン、免疫細胞の数・機能など)など
細胞培養系においてPHANTOMやLPS刺激などに伴う免疫系変化(mRNA、サイトカイン、免疫細胞の数・機能など)など














