厚生労働科学研究費補助金(こころの健康科学研究事業)
分担研究報告書
自律神経機能異常を伴い慢性的な疲労を訴える患者に対する客観的な疲労診断法の確立と慢性疲労診断指針の作成
慢性疲労患者における唾液の生物学的評価
分担研究者 近藤 一博 (東京慈恵会医科大学ウイルス学講座教授)
研究協力者: 小林 伸行 (東京慈恵会医科大学ウイルス学講座)
研究要旨
唾液検査は採取が簡単で、日々の生活の上で疲労をチェックする方法として有用な検査手段を提供してくれる可能性がある。 しかし、現在行なわれている検査では、短期的なストレスを測定することは可能であるが、ストレスの蓄積の結果生じる疲労を測定することはできない。 我々は、疲れるとヘルペスがでるという良く知られた現象をヒントに、唾液中に再活性化するヒトヘルペスウイルス6(HHV-6)を定量することによる疲労測定法を開発した。 今回の研究では、HHV-6の潜伏感染・再活性化機構を突き詰めることによって、疲労因子(FF)の候補を選択肢、さらに、マウスの疲労モデルを検証することにより、疲労因子(FF)を同定することに成功した。 また、FFは、ヒトの末梢血を検体とした検査においても、客観的に疲労を検査できることが判明した。 さらに、FFの測定は、精神疲労と肉体疲労の両者において有効であることが判明した。
これにより、唾液中HHV-6測定と血液中の疲労因子(FF)の測定という、2つの客観的疲労測定法を得ることができた。
A. 研究目的
「疲労」は休みなく心身を使うことによって生体機能に障害が生じた状態を、「疲労感」は疲労を脳が主観的に定量する感覚を指す。 「疲労感」は、報酬や、やり甲斐などでマスクされ易いため、「疲労感」のみで「疲労」を定量しようとすると、様々な問題が生じる。そこで、「疲労」を客観的に測定するために、疲労によって変化する生体のバイオマーカーを発見し、これを利用して疲労を測定する様々な方法が検討されている。
我々は、疲労を客観的に測定するために、「疲れるとヘルペスという水泡が唇にできる」という現象に着目した。 この現象は、通常は宿主の体内に潜伏感染しているヘルペスウイルスが、疲労によって宿主の危機が生じると再活性化し、他の宿主を求めて体外に放出されるという現象である。ヒトのヘルペスウイルスは8種類知られているが、この中でも労働による疲労にはヒトヘルペスウイルス6(HHV-6)が良く反応することが判った。 これは、疲労の客観的測定法の開発原理として利用可能であるので、唾液中HHV-6測定による疲労の客観的測定法の開発に着手した。
一方、HHV-6が疲労に反応して再活性化するということは逆に、疲労によるヘルペスウイルス再活性化のメカニズムを解析すれば、疲労の分子メカニズムを解明することが可能となることを示している。
数年前に乳酸が疲労物質でないことが明らかにされてから、疲労の分子メカニズムは、返って謎となった。 我々は、HHV-6の再活性化機構を詳細に検討することで、疲労因子を同定している。この因子は、マウスに不眠や水泳などによる疲労を与えると様々な臓器で発現が亢進することと、この因子を遺伝子導入によって発現を誘導すると、マウスの自発運動量が低下することから、疲労という現象の中心的な働きをする因子であると考えられた。また、この因子の働きを抑制する因子も疲労負荷によって発現が亢進することが判り、この研究が、疲労のメカニズムの解明や疲労回復法の開発を可能にするものと考え、今回の研究課題とした。
B. 研究方法
1. 疲労のシグナル伝達径路および疲労因子(FF)の同定
ⅰ. 疲労と疲労感におけるシグナル伝達径路の解明のための作業仮説
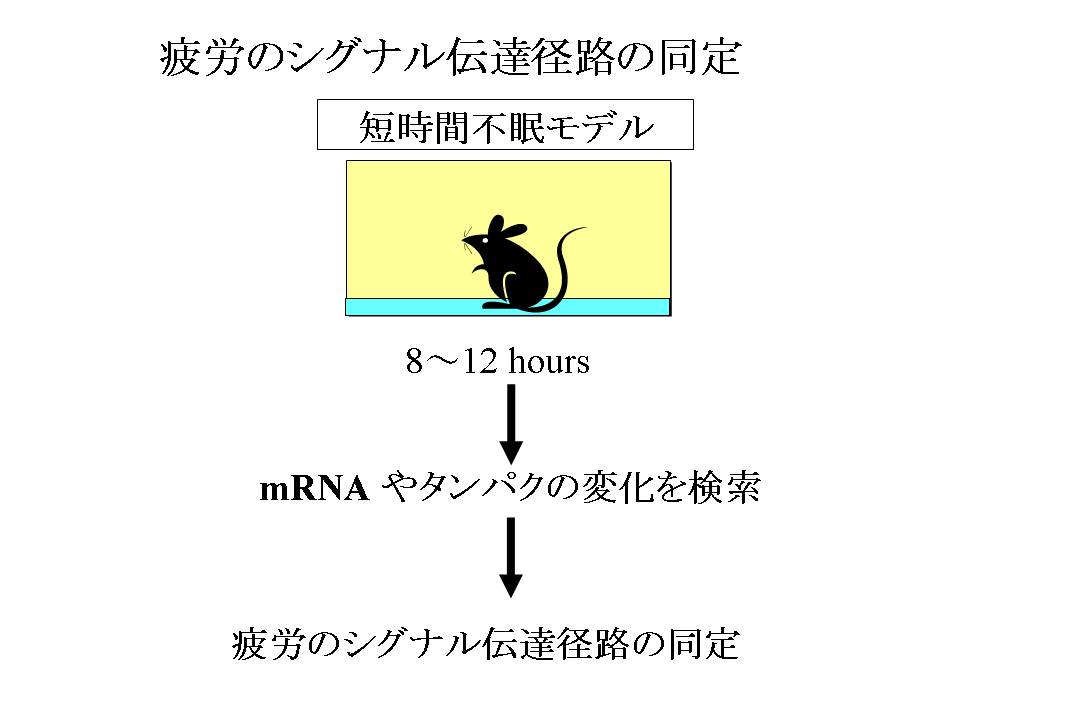
疲労のシグナル伝達径路に関する作業仮説を示す。 疲労の最初の原因として、まず、末梢の臓器や筋肉における、基礎代謝を含む生命活動によって、一種の老廃物である疲労物質が作られる。これは、従来の乳酸に相当するものである。 疲労物質は、疲労因子(シグナル伝達物質)を誘導する。 疲労因子は、さらに、脳へ疲労を伝える疲労メディエーターであるサイトカイン産生を促し、脳へ疲労感を伝える。
今回の研究では、この作業仮説に従って、疲労物質や疲労因子を同定することによって、疲労の分子メカニズムを解明使用としている。 なお、疲労メディエーターとなるサイトカインは、TGF-β、インターフェロン、IL-1β、IL-6など、多くの候補があげられているが、おそらく、これらは重複性が強く、何れもが疲労メディエーターとなりうるものであると考えられる (図1)。
疲労因子および疲労物質の必要条件は、以下の様になる。
① 疲労因子/疲労物質は、疲労に伴って増加する。
② 疲労因子/疲労物質は、 これを生体に導入することによって疲労を誘導できる。
我々は、この様な条件を満たす、真の疲労因子(疲労伝達物質)と、生命現象の老廃物として生じる真の疲労物質を検索している。
ⅱ. 疲労のシグナル伝達径路の同定
疲労とストレス応答は、しばしば混同される概念である。 その理由は、ストレス研究に対して疲労研究が遅れていることと、ストレスによっても疲労が誘導されることによると思われる。 しかし、ストレス研究をそのまま持ち込むだけでは、疲労のシグナル伝達径路を明らかにすることは出来なかった。 このことは、ストレス応答とは異なる「疲労シグナル伝達径路」が存在することを示している。
我々は、強いストレスによらず、持続的な疲労負荷による疲労を感知する疲労シグナルを同定するために、最も外的刺激が弱いと思われる疲労マウスモデルを使用した。 このモデルは、ケージに1cmの常温の水を入れたために、マウスは横になって寝ることが出来ないというモデルである。 通常のストレスの実験では、5日~1週間程度この状態を保つことが多いが、我々は、1晩だけマウスの睡眠を妨げるという緩やかな条件で疲労を誘導した。 これは、いわゆるストレス応答によるシグナルの混入を避け、純粋な疲労シグナルを検索するためである(図2)。
ⅲ. 疲労マウスに対するDNAマイクロアレイ解析
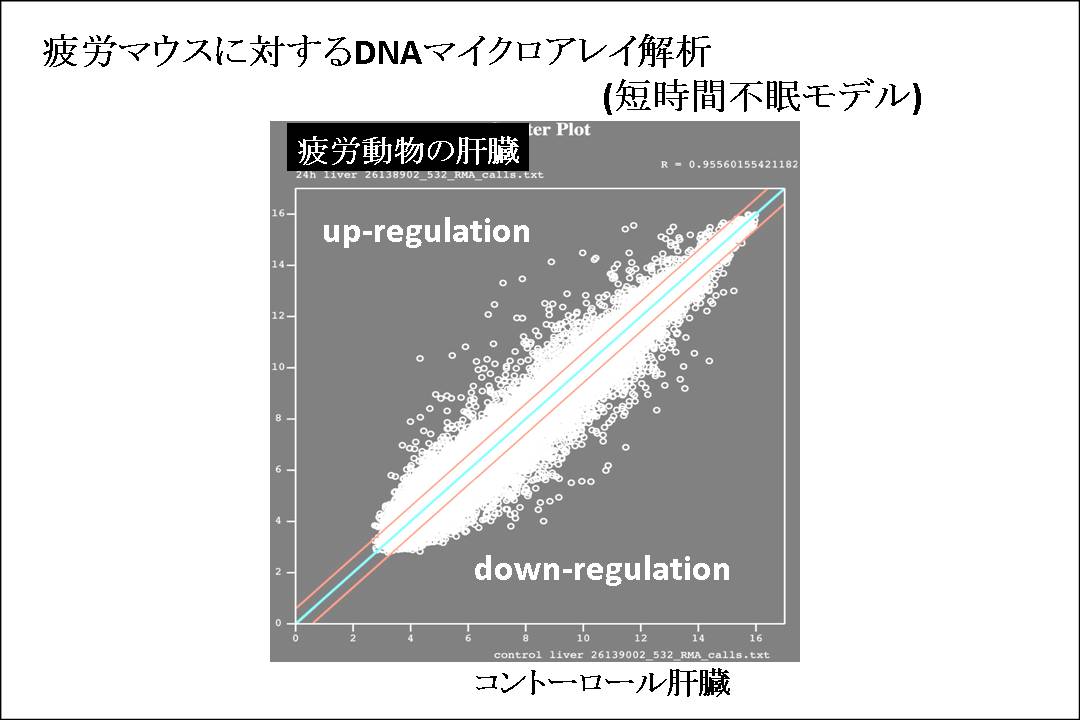
この非常にマイルドな疲労条件に対して、発現は変化する遺伝子を、DNAマイクロアレイ解析で検討した。
DNAチップには約20,000種類の遺伝子が載せてあり、疲労動物とコントーロール動物の肝臓のmRNAを測定した。
ⅳ. 疲労因子(FF)の同定
疲労によって宿主の体内に潜伏感染しているヘルペスウイルスが、再活性化することは良く知られている。 我々はその中でも労働による疲労にはヒトヘルペスウイルス6(HHV-6)が良く反応することを見出した(図4)。 さらに、ウイルス学的な研究により、我々は、HHV-6の潜伏感染・再活性化機構の多くを明らかにしてきた。
この様なHHV-6の再活性化のメカニズムの研究と、マイクロアレイの結果などを総合して、疲労の際にHHV-6の再活性化を誘導する因子として、疲労因子(FF)の検索を行なった。
2. 疲労因子(FF)の発現と機能解析
ⅰ. 疲労因子(FF)のマウスモデルにおける発現
疲労による疲労因子(FF)の発現を検討するために、短時間不眠疲労モデルにおける疲労因子のmRNA発現を、Real-time PCR法で測定した。 また、運動負荷による疲労因子(FF)の増加も、2時間の自由水泳による疲労モデルで検討した。
過労によって障害されることが知られている臓器からRNA精製を行い、内部標準のGAPDH遺伝子の量で割り算した値を、疲労の有無で比較した。
まず、マウス疲労モデルにおける疲労因子(FF)の発現 を12時間の不眠疲労モデルで検討した。 続いて、疲労因子(FF)が他の疲労によっても増加するかどうかを検討した。
ⅱ. 疲労因子(FF)の機能解析
疲労因子(FF)の性質の機能を検討するために、生体内でのFFによる疲労のメディエーターである炎症性サイトカインの誘導を検討した。 方法としては、疲労因子のin vivoトランスフェクションの8時間後に、IL-1betaとIL-6のmRNAを、Real-time PCR法で定量した。
疲労に関する問題として、過労による臓器機能の障害と過労死の問題が挙げられる。 疲労因子(FF)による臓器障害の可能性を検討するために、FFによってapoptosisの誘導の増強が生じるかどうかを検討した。 バックグラウンドのapoptosis刺激としては、Camptothecin (CPT) およびetoposide (VP-16 )を使用した。
ⅲ. ヒトにおける疲労と疲労因子(FF)の関係
マウス実験系で見出したFFとFFと疲労との関係が、ヒトにおいても成立するかどうかを検討した。 方法としては、肉体疲労として、非常に軽度の肉体労働(短時間の栗拾い)の前後におけるFFの変化を検討した。 FFの測定はmRNA発現量をReal-time PCR法で測定し、値は、FFの値をハウスキーピング遺伝子であるGAPDHのmRNAの値で割ったものの変化を検討した。 精神疲労としては、睡眠不足を利用した。 測定前3日間の平均睡眠時間とFFとの関係を検討した。 FFの測定は、肉体疲労と同様にmRNA発現量をReal-time PCR法で測定した。 検体としては、末梢血(全血)からRNAを精製して用いた。
(倫理面への配慮)
インフォームドコンセントを取るに当たり、厚生労働省のガイドラインに準拠した同意書を作成し、これに患者またはこれに代わる親権者の同意を得た。全ての研究の過程は東京慈恵会医科大学・倫理委員会の承認を得たプロトコールにしたがって行われた。遺伝子組換え実験は東京慈恵会医科大学・遺伝子組み換え委員会の承認の後、遺伝子組換え実験ガイドラインに沿って行われた。動物実験は、東京慈恵会医科大学・実験動物委員会の承認を得て行なった。
C. 研究結果
1. 疲労のシグナル伝達径路および疲労因子(FF)の同定
ⅱ. 疲労のシグナル伝達径路の同定
ストレス応答とは異なる「疲労シグナル伝達径路」を同定するために、強いストレスによらず、持続的な疲労負荷を用いた。実際には、最も外的刺激が弱いと思われる疲労マウスモデルを使用した。 このモデルは、ケージに1cmの常温の水を入れたために、マウスは横になって寝ることが出来ないというモデルである (図2)。
ⅲ. 疲労マウスに対するDNAマイクロアレイ解析
最初に、この疲労マウスに対するDNAマイクロアレイ解析を行なった。 DNAチップには約20,000種類の遺伝子が載せてあり、疲労動物とコントーロール動物の肝臓のmRNAを測定した。 図3に示す様に、極めて多数の遺伝子が、この様なマイルドな条件でも、上昇または下降することが判明した。 他の研究者の報告でも、疲労による遺伝子変化は、数千種類の遺伝子に及ぶとされており、我々の条件でも同様の結果となり、疲労に関する遺伝子の同定をDNAマイクロアレイによって行なうことには、無理があるとの結論に達した。
ⅳ. 疲労因子(FF)の同定
HHV-6の潜伏感染・再活性化のメカニズムの研究から得た情報と、マイクロアレイの結果などを総合して、疲労の際にHHV-6の再活性化を誘導する因子として、疲労因子(FF)を同定した。
2. 疲労因子(FF)の発現と機能解析
ⅰ. 疲労因子(FF)のマウスモデルにおける発現
疲労による疲労因子(FF)の発現を検討するために、疲労因子(FF)のmRNA発現を、Real-time PCR法で測定した。 また、運動負荷による疲労因子(FF)の増加も、2時間の自由水泳による疲労モデルで検討した。 過労によって障害されることが知られている臓器からRNA精製を行い、内部標準のGAPDH遺伝子の量で割り算した値を、疲労の有無で比較した。
FFの発現 を12時間の不眠疲労モデルで検討した結果、脳、心臓、膵臓、肝臓、筋肉と血液を含む多くの臓器において、疲労因子は、有意に増加した。
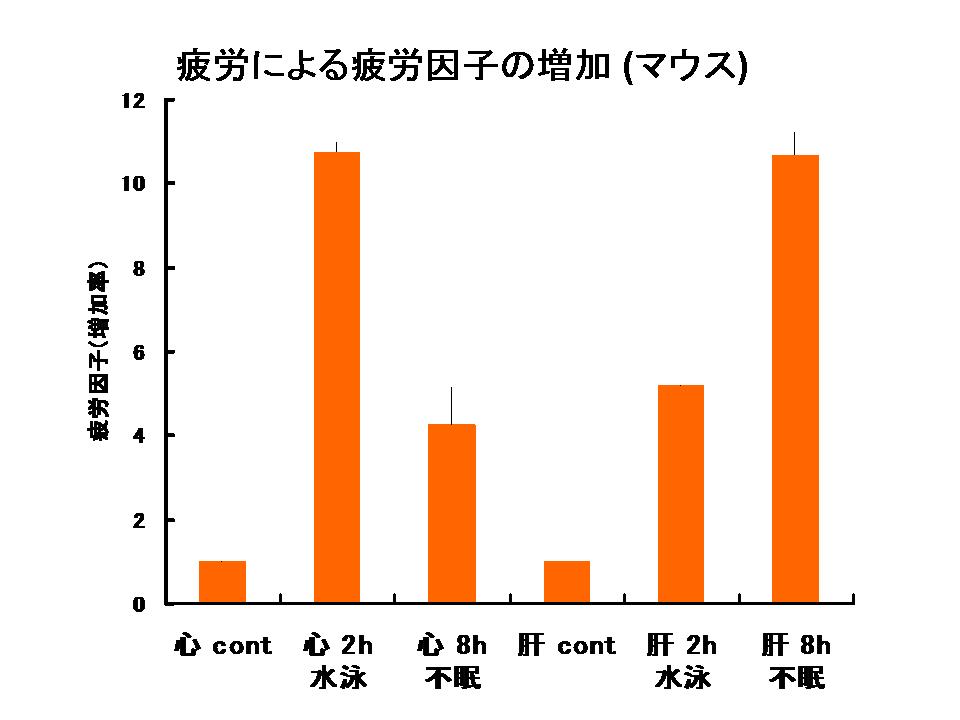
疲労因子(FF)が他の疲労によっても増加するかどうかを検討した。 図5のグラフに示される様に、疲労因子(FF)は、不眠と同じく、水泳によっても増加することが判明した。
なお、この水泳は、重りなどを用いない自由な水泳で、マウスは、2時間の自由水泳時間の間、実際には10~15分程度しか泳いでおらず、後の時間は浮いているだけであった。 このことは、FFが従来のストレス負荷モデルに比して、極めて弱い刺激で反応していることを示すものであった。
ⅱ. 疲労因子(FF)の機能解析
疲労因子(FF)の性質の機能を検討するために、生体内でのFFによる疲労のメディエーターである炎症性サイトカインの誘導を検討した。 この結果、疲労因子(FF)は、これらの炎症性のサイトカインを誘導することが判った。
これらのサイトカインは、脳に疲労を伝達する疲労メディエーターであると考えられている分子であることから、図1に示す作業仮説通り、疲労因子(FF)と「疲労」という現象との関係に、疲労因子(FF)のサイトカイン誘導能が関係することが示唆された。
疲労に関する問題として、過労による臓器機能の障害と過労死の問題が挙げられる。 疲労因子(FF)による臓器障害の可能性を検討するために、FFによってapoptosisの誘導の促進が生じるかどうかを検討した。 バックグラウンドのapoptosis刺激としては、Camptothecin (CPT) およびetoposide (VP-16 )を使用した。 この結果、apoptosisは疲労因子(FF)によって促進されることが判り、疲労による過労死の一因であると考えられた。
ⅲ. ヒトにおける疲労と疲労因子(FF)の関係
マウス実験系で見出したFFと疲労との関係が、ヒトにおいても成立するかどうかを検討した。 非常に軽度の肉体労働(短時間の栗拾いと、精神疲労として睡眠不足による疲労を測定した。 この結果、両者において、疲労とFFが相関することが示された。 この測定は、末梢血(全血)を用いて測定を行なっており、疲労因子(FF)の測定は、通常の健康診断レベルの採血検査に応用できることを示すものであった。
(図1)クリックで拡大
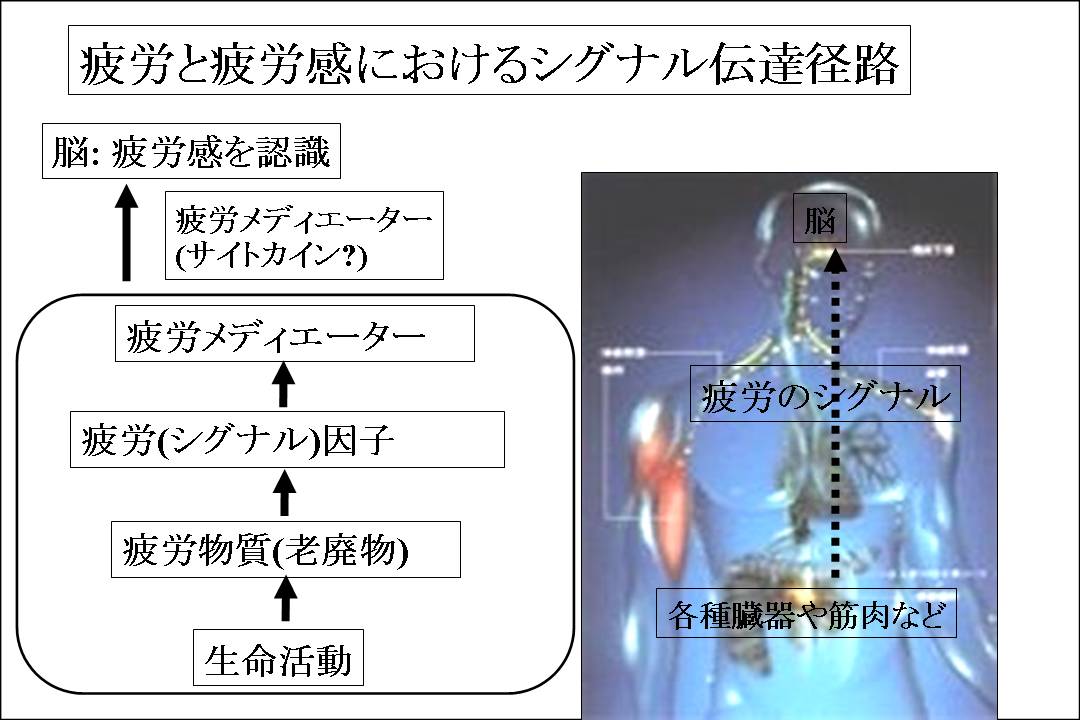
図1: 疲労と疲労感におけるシグナル伝達径路
疲労のシグナル伝達径路に関する作業仮説を示す。疲労の最初の原因として、まず、末梢の臓器や筋肉における、基礎代謝を含む生命活動によって、一種の老廃物である疲労物質が作られる。これは、従来の乳酸に相当するものである。疲労物質は、疲労因子(シグナル伝達物質)を誘導する。 疲労因子は、さらに、脳へ疲労を伝える疲労メディエーターであるサイトカイン産生を促し、脳へ疲労感を伝える。
(図2)クリックで拡大
図2: 疲労のシグナル伝達径路の同定
強いストレスによらず、持続的な疲労負荷による疲労を感知する疲労シグナルを同定するために、最も外的刺激が弱いと思われる疲労マウスモデルを使用した。 このモデルは、ケージに1cmの常温の水を入れたために、マウスは横になって寝ることが出来ないというモデルである。 通常のストレスの実験では、5日~1週間程度この状態を保つことが多いが、我々は、1晩だけマウスの睡眠を妨げるという緩やかな条件で疲労を誘導した。
(図3)クリックで拡大
図3: 疲労マウスに対するDNAマイクロアレイ解析
この非常にマイルドな疲労条件に対して、発現は変化する遺伝子を、DNAマイクロアレイ解析で検討した。
(図4)クリックで拡大
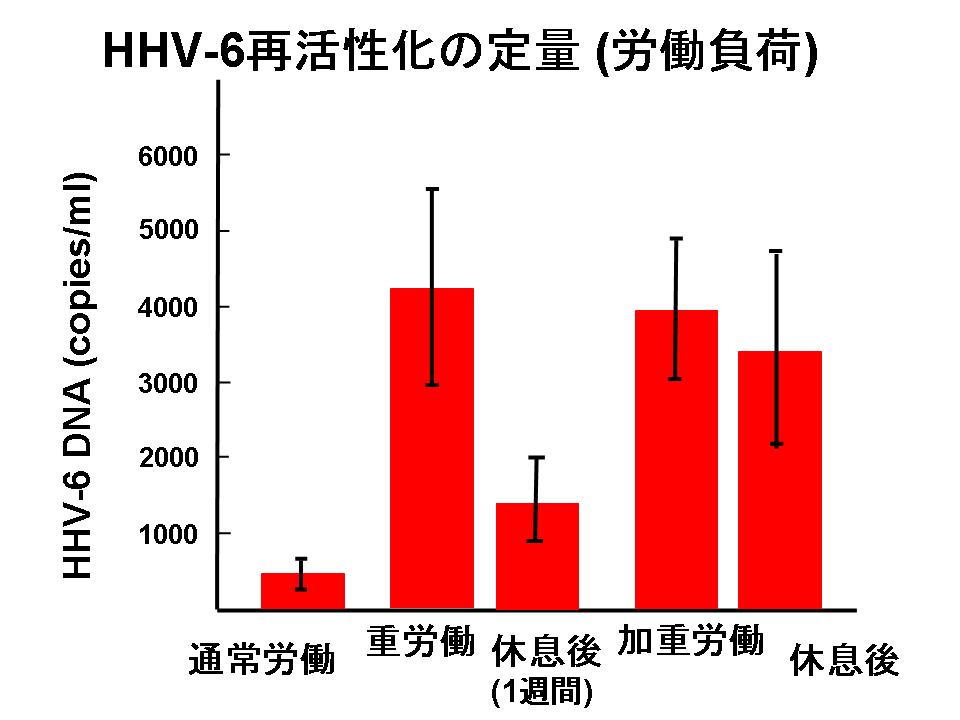
図4: 唾液中HHV-6と疲労との関係
全ての人の体内に潜伏感染しているヒトヘルペスウイルス6(HHV-6)が再活性化して唾液中に排出することを示す。
(図5)クリックで拡大
図5: 運動負荷による疲労因子(FF)の増加
疲労因子(FF)が他の疲労によっても増加するかどうかを検討した。 グラフに示される様に、疲労因子(FF)は、不眠と同じく、水泳によっても増加することが判明した。
なお、この水泳は、重りなどを用いない自由な水泳で、マウスは、2時間の自由水泳時間の間、実際には10~15分程度しか泳いでおらず、後の時間は浮いているだけであった。
(図6)クリックで拡大
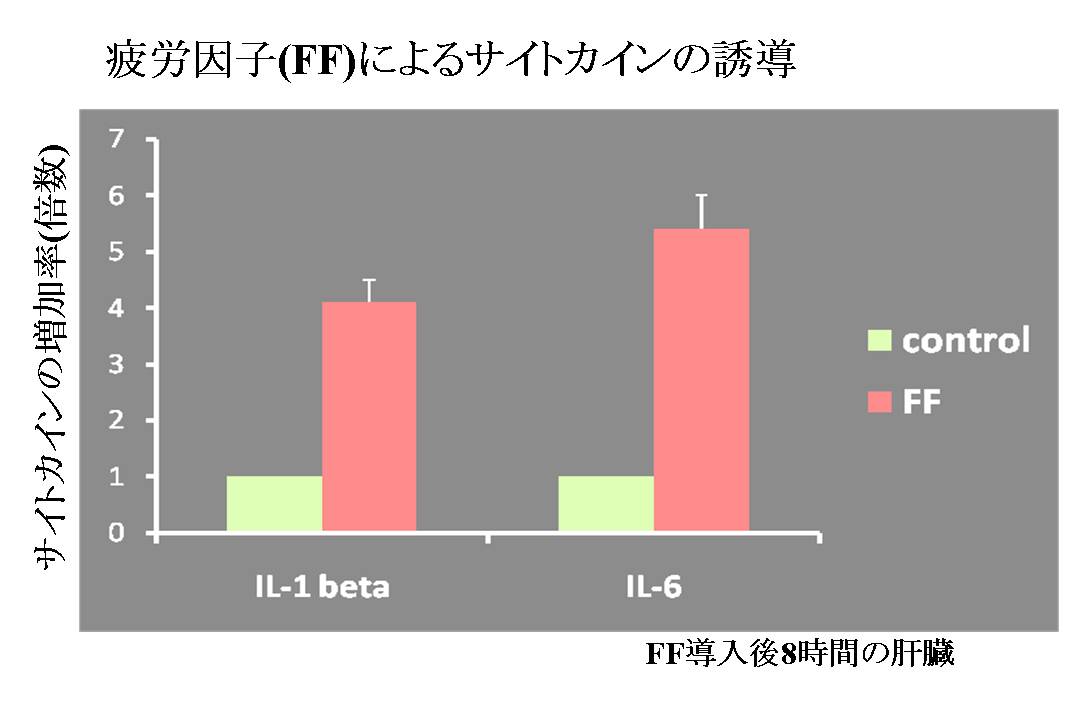
図6: 疲労因子(FF)によるサイトカインの誘導
生体内でのFFによる疲労のメディエーターである炎症性サイトカインの誘導を検討した。 方法としては、疲労因子のin vivoトランスフェクションの8時間後に、IL-1betaとIL-6のmRNAを、Real-time PCR法で定量した。
(図7)クリックで拡大
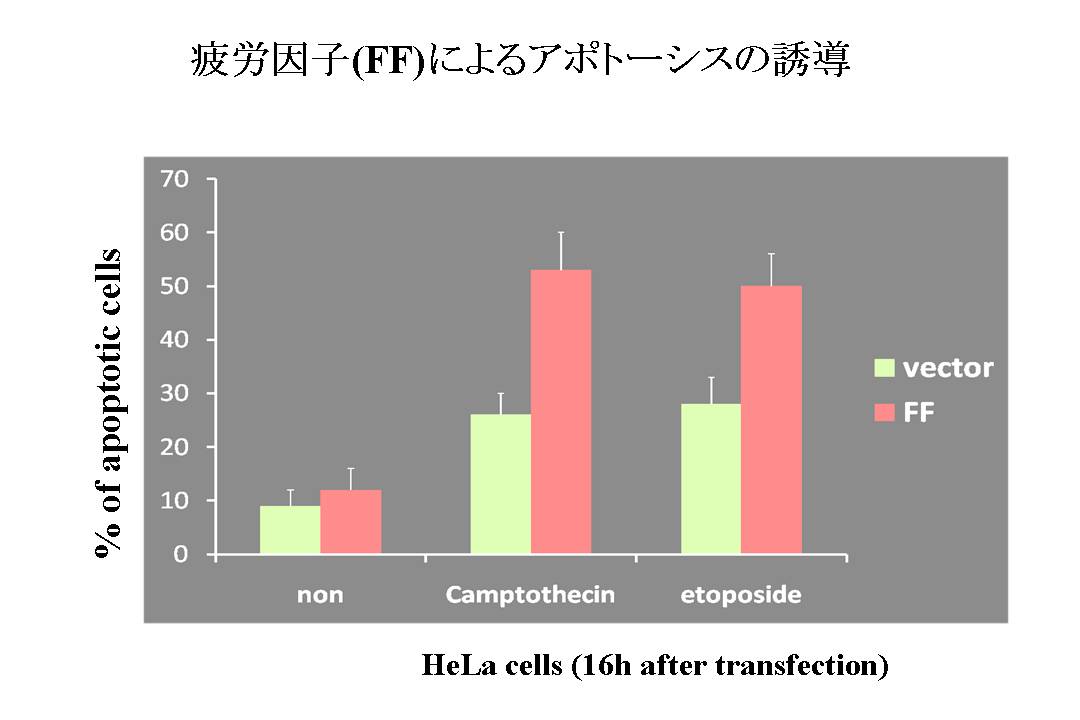
図7: FFによるApoptosisの誘導の増強
Apoptosis誘導のバックグラウンドとしてCamptothecin (CPT) とetoposide (VP-16)を使用し、疲労因子(FF)がapoptosisの誘導を増強するかどうかを検討した。
(図8)クリックで拡大
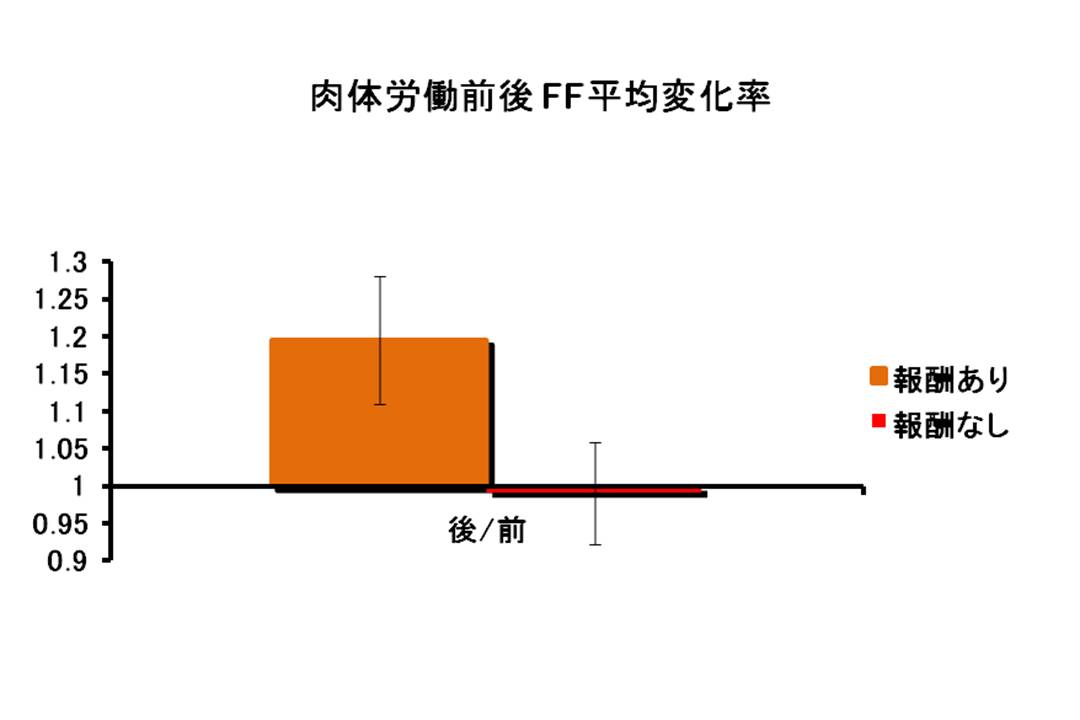
図8: ヒトにおける肉体労働前後のFFの増加
ヒトの非常に軽度の肉体労働(短時間の栗拾い)の前後におけるFFの増加を示す。 FFの測定はmRNA発現量をReal-time PCR法で測定し、値は、FFの値をハウスキーピング遺伝子であるGAPDHのmRNAの値で割ったもので示した。
(図9)クリックで拡大
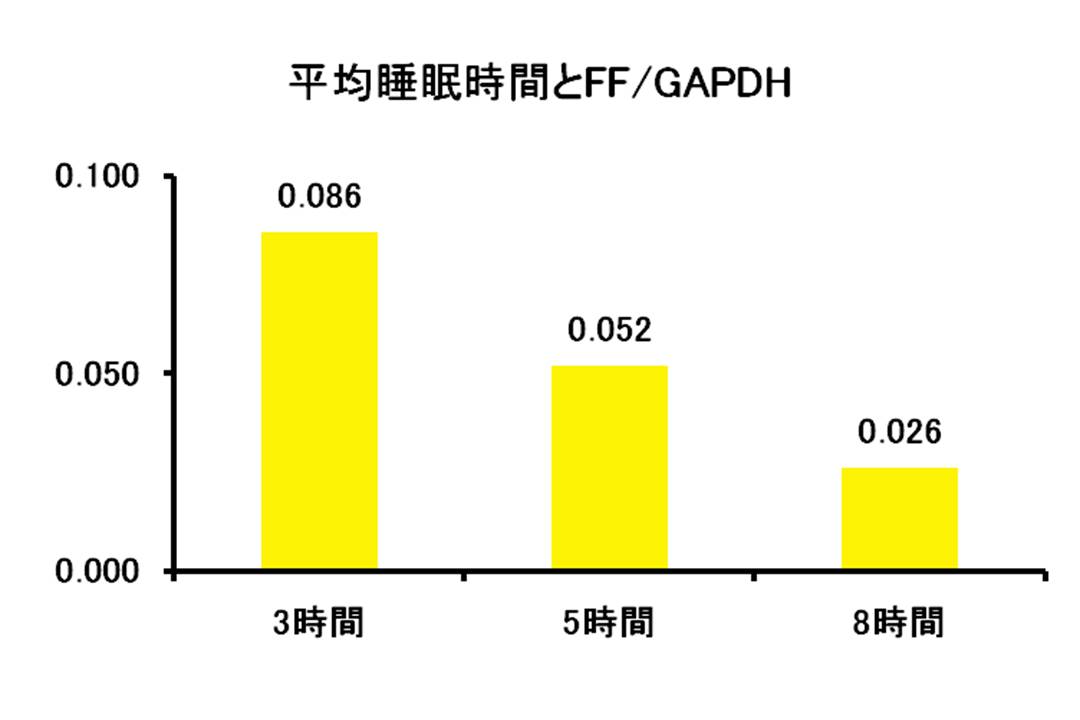
図9: ヒトの睡眠時間とFFとの関係
ヒトの睡眠時間とFFの関係を示す。 睡眠時間は、測定前3日間の平均睡眠時間である。FFの測定はmRNA発現量をReal-time PCR法で測定し、値は、FFの値をハウスキーピング遺伝子であるGAPDHのmRNAの値で割ったもので示した。
D. 考察
唾液検査は採取が簡単で、日々の生活の上で疲労をチェックする方法として有用な検査手段を提供してくれる可能性がある。 しかし、現在行なわれている検査では、短期的なストレスを測定することは可能であるが、ストレスの蓄積の結果生じる疲労を測定することはできない。 我々は、疲れるとヘルペスがでるという良く知られた現象をヒントに、唾液中に再活性化するヒトヘルペスウイルス6(HHV-6)を定量することによる疲労測定法を開発した。 この方法は、労働による疲労を客観的に疲労を測定出来るだけでなく、抗癌剤の副作用による疲労を測定することも可能である。
しかし、この方法による疲労測定法を信頼できるものとするためには、この測定法の原理、すなわち、「なぜ疲労によってHHV-6が再活性化するか」を明らかにする必要があった。 ところが、これを明らかにするためには、疲労の分子メカニズムそのものを明らかにしなければならない。 今回の研究では、HHV-6の潜伏感染・再活性化機構を突き詰めることによって、疲労因子(FF)の候補を選択肢、さらに、マウスの疲労モデルを検証することにより、疲労因子(FF)を同定することに成功した。
また、FFは、ヒトの末梢血を検体とした検査においても、客観的に疲労を検査できることが判明した。 さらに、FFの測定は、精神疲労と肉体疲労の両者において有効であることが判明した。
今後は、唾液中HHV-6測定と血液中の疲労因子(FF)の測定という、2つの方法で疲労を客観的 に測定し、この方法の有効性と利用法を検証して行く予定である。
E. 結論
我々は、疲労によって全ての人の体内に潜伏感染しているヒトヘルペスウイルス6(HHV-6)が再活性化して唾液中に排出することを利用した疲労測定法を開発した。今回の研究では、唾液中HHV-6測定の信頼性を高める目的で、HHV-6の潜伏感染・再活性化機構を突き詰め、疲労因子(FF)を同定することに成功した。
FFは、ヒトの末梢血を検体とした検査においても、客観的に疲労を検査できることが判明し、FFの測定は、精神疲労と肉体疲労の両者において有効であることが判明した。
これにより、唾液中HHV-6測定と血液中の疲労因子(FF)の測定という、2つの客観的疲労測定法を得ることができた。
F. 健康危険情報
特になし
G. 研究発表
1. 論文発表
なし
2. 学会発表
1. 招待講演 K. Kondo
Identification of a novel molecular mechanism and a major cause of fatigue.
36th International Congress of Physiological Sciences. Late-breaking symposium
(Aug.1 Kyoto 2009)
2. A. Shimizu and K. Kondo
Application of human herpesvirus 6 (HHV-6) for the gene therapy vector
14th International Conference on Immunology and Prophylaxis of Human Herpesvirus Infection (Oct. 6 Kobe 2009)
3. M. Kamada and K. Kondo
Establishment of SCID-hu mouse model for human herpesvirus 6 (HHV-6) latent infection and identification of HHV-6 latent cells
14th International Conference on Immunology and Prophylaxis of Human Herpesvirus Infection (Oct. 6 Kobe 2009)
4. N. Kobayashi and K. Kondo
Identification of novel HHV-6 latent protein associated with CFS and mood disorders
14th International Conference on Immunology and Prophylaxis of Human Herpesvirus Infection (Oct. 6 Kobe 2009)
5. K. Shimada and K. Kondo
Alternative splicing regulation of human herpesvirus 6 (HHV-6) ie1/ie2 genes by immediate-early 2 and splicing factor SART3
14th International Conference on Immunology and Prophylaxis of Human Herpesvirus Infection (Oct. 6 Kobe 2009)
6. 小林伸行、嶋田和也、清水昭宏、近藤一博
ヒトヘルペスウイルス(HHV)-6 関連疾患における、多彩な精神症状の出現機構に関する検討
(第57回日本ウイルス学会、2009年10月 東京)
7. 鎌田美乃里、近藤一博
HHV-6感染SCID-huマウス末梢血中のHHV-6 genome出現の検討
(第57回日本ウイルス学会、2009年10月 東京)
8. 清水昭宏、小林伸行、近藤一博
組み換えヒトヘルペスウイルス6へのbacterial artificial chromosome (BAC)システムの導入と、産生条件の検討
(第57回日本ウイルス学会、2009年10月 東京)
9. 嶋田和也、近藤一博
ヒトヘルペスウイルス6(HHV-6)前初期遺伝子産物IE2とスプライシング関連因子SART3の相互作用によるie1/ie2の選択的スプライシング調節
(第57回日本ウイルス学会、2009年10月 東京)
3. 書籍等
1. 近藤一博
疲労のバイオマーカー: 唾液中ヒトヘルペスウイルス6(HHV-6)
「最新・疲労の科学」p76-80別冊・医学のあゆみ(医歯薬出版2010年1月).
H. 知的財産権の出願・登録状況
1. 近藤一博
疲労因子(FF)と疲労回復因子(FR)の同定とその利用法
(特許出願準備中)