資料1.
E&D CF研究計画の詳細
<研究課題名>自律神経機能異常を伴い慢性的な疲労を訴える患者に対する
客観的な疲労診断法の確立と慢性疲労診断指針の作成
(Evaluation & Diagnosis for Chronic Fatigue)
目次
目的
疲労の診療、研究に携わっている専門家が集結し、自律神経機能をはじめとする客観的な疲労マーカーを用いて慢性疲労病態を評価し客観的な診断法を確立する。また、疲労診療の手引きとなる慢性疲労診断指針の作成を行うことを目的とした研究を実施する。
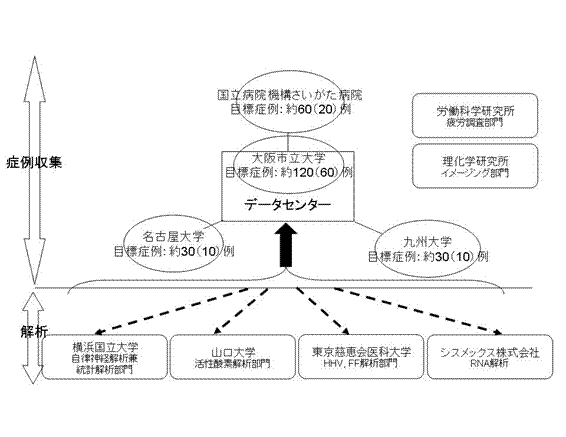
現在、日本において慢性疲労を診療・臨床研究の対象と掲げている代表的な疲労診療施設である①大阪市立大学疲労クリニカルセンター(120例)、②名古屋大学医学部附属病院総合診療科(30例)、③国立病院機構さいがた病院(60例)、④九州大学病院心療内科(30例)の4施設において約200名(括弧内は目標症例数)に対して実施し、客観的な評価系となりうる検査について感度や特異度を明確にする。
試験方法
試験デザイン
横断的臨床研究
試験方法
試験開始前に試験責任医師または試験分担医師は、試験内容を被験者に十分に説明し、試験参加に同意した被験者の背景データを確認するとともに問診を行う。また、後述2.3に示す検査を実施する。
背景データの調査項目は以下のカルテ情報とする。
- 同意取得日
- 性別
- 生年月日
- 身長、体重(当日に測定しない場合は、身長・体重はカルテに記載されている中で一番新しいデータを記載)
- 発症時期(明確であれば年月を記載、不明確のときはその旨記載)
- 診断基準(厚生省、CDC、日本疲労学会、各々の診断基準を満たしたか)
- 精神疾患合併の有無(わかれば診断名およびICD-10 F番号1桁を記載)
- 現在の喫煙の有無
- 服薬およびサプリメント摂取状況
ビタミンC、ビタミンE、CoQ10、カルニチン、向精神病薬(抗精神病薬、抗うつ薬、抗不安薬、睡眠薬を含む)
- 検査時間、検査2時間前からの飲食の有無
- 各検査についての実施の有無
検査項目
1)唾液
- 唾液アミラーゼ測定:検査値をデータシートの該当欄に記入する。測定方法は取扱説明書を参照のこと。
- 唾液中のHHV-6、HHV-7のDNA量からの生物学的評価(解析担当:東京慈恵会医科大学)唾液採取及び保管方法は手順書参照のこと
2)問診票:“きりつ名人”内の問診票、PSはCSVファイル、それ以外はコピーを大阪市立大学へ郵送。必須項目。
- 疲労問診票:主観的疲労感の把握
きりつ名人画面上で評価。手順書参照のこと。
- Performance Status (PS):疲労による社会生活レベルの低下を担当医が0~9段階で評価。きりつ名人画面上で評価。手順書参照のこと。
- Chalder Fatigue Scale:主観的疲労感の把握
質問紙(14項目)に疲労感の程度を記入。様式は送付のもの。
- 疲労感 Visual Analog Scale (VAS):主観的疲労感の把握
10cmの線上にバツ印で疲労感の程度を記入。様式は送付のもの。
- CES-D:抑うつの把握
質問紙(20項目)に抑うつ症状の頻度を記入。各施設で購入。
参考URL http://www.saccess55.co.jp/kobetu/detail/ces-d.shtml
3)きりつ試験:“きりつ名人”を用いた自律神経機能評価(解析担当:横浜国立大学):CSVファイルを横浜国立大学へ送付。試験方法については“きりつ名人”付属の手順書を参照のこと。
4)採血:午前9時から11時の間の採取が望ましい(採取時間と飲食の有無をデータシートに記入)検体は指定の内容を山口大学、シスメックス株式会社、東京慈恵会医科大学へ郵送。
- DNAチップ解析:遺伝子発現プロファイルによる病態判定(解析担当:シスメックス株式会社)
- d-ROM、BAPを用いた酸化ストレス、抗酸化力の評価(解析担当:山口大学)
- 自己抗体と疲労との関連解析(DFS抗体)(解析担当:山口大学)
- 疲労因子(Fatigue Factor)の評価(解析担当:東京慈恵会医科大学)
- 血清、血漿をそれぞれ0.5ml×5本:スピッツは各施設研究費で購入・遠心・分注まで担当。血清0.5ml、1本を山口大学へ郵送。ドライアイスで詰めて送付(保存は、-20度もしくは-80度、-80度推奨)残り(血清4本、血漿5本)は各施設で保存
- RNA用採血管2.5ml×4本:スピッツはシスメックス株式会社が準備。3本をシスメックス株式会社へ、1本を東京慈恵会医科大学へ郵送。ドライアイスを詰めて送付。
注:全体で約20mlの採血が必要です。ご参考までに、大阪市大では翼状針21Gを用いて採血し、18G針に付け替えて分注しております。
種類 |
必要量 |
検査項目 |
送付先 |
血清 0.5ml×5本 |
|
d-ROM、BAP DFS抗体 |
山口大学へ送付 |
|
新たな検査を 追加する可能性があるための予備 |
各施設で保存 |
|
血漿 0.5ml×5本 |
|
新たな検査を 追加する可能性があるための予備 |
各施設で保存 |
RNA用 2.5ml×4本 |
|
DNAチップ解析
|
シスメックス株式会社へ送付 |
|
疲労因子(FF) |
東京慈恵会医科大学へ送付 |
5)認知課題:CSVファイルを大阪市立大学へ送付
中央データセンターから送付されるプログラム(CD-ROM)をインストールする。(“きりつ名人”と同じパソコンを使用してもよい。)
a) 単純計算課題(YS-03)(解析担当:大阪市立大学):計算課題。精神負荷課題。手順書参照のこと。
b) 二重負荷試験(解析担当:大阪市立大学):前頭葉負荷試験。手順書参照のこと。
6)アクティグラフを用いた覚醒・睡眠リズムの解析(解析担当:大阪市立大学):電子データ及び行動記録表を大阪市立大学へ送付
72時間(注)、0クロッシング法
行動記録表には「機器の脱着、入眠(昼寝を含む)、起床、入浴」を記入
(注)72時間測定するために、アクティグラフの取り外しは記録時刻の関係から3日後の12時(正午)以降にしてください。

検査スケジュール
測定および観察のスケジュールは以下の表の通りである。
検査は以下の順序で行うことが望ましい。問診票、質問紙票は検査当日が望ましいが検査前後1~2週間程度の誤差はよいものとする。
注:唾液採取(サリベット)において必要量を採取する時間には個人差が大きいため、大阪市大では質問紙や問診票記入時にサリベットを口に含んでいただき採取しております。
|
検査日以外 |
検査日 |
3日後 |
所要時間 |
1.同意説明 、問診 |
○*1 |
|
|
約10分 |
2.唾液 HHV |
|
○ |
|
約5~10分 |
アミラーゼ |
|
○ |
|
約3分 |
3.質問紙 *2 Chalder Fatigue Scale |
△ |
○ |
△ |
約2分 |
VAS |
△ |
○ |
△ |
約1分 |
CES-D |
△ |
○ |
△ |
約2分 |
4.きりつ名人 問診票、PS |
|
○ |
|
約5分 |
自律神経機能検査 |
|
○ |
|
約15分 |
5.認知課題 |
|
○ |
|
約15分 |
6.採血 血清 |
|
○ |
|
約5分 |
血漿 |
|
○ |
|
|
RNA |
|
○ |
|
|
7.アクティグラフ |
|
○àà |
取り外し*3 |
約2分 |
*1 同意説明と同意取得は検査前に完了すること。 *2 質問紙は期間中に一回実施。
*3 12時(正午)以降であること。
被験者が守るべき事項
検査2時間前には食事を済ませておく。水の摂取は可。
インフォームド・コンセントのための手続き
本研究は、各実施医療機関の倫理委員会にて審議され、承認された研究である。同意説明文書は承認された研究課題の書類を使用し、文書にて同意(複数ある場合にはすべてに同意)を得るものとする。
各実施医療機関で収集したデータ/検体の回収方法
規定のデータ回収時期まで各施設にてデータ/検体を保管し、送付時期にまとめて発送する。発送時には、あらかじめ作成された宛先ラベルを利用して、指定の機関に送付する。
以下、特記事項を示す。
- データシート:大阪市立大学医学部附属病院 医薬品・食品効能評価センターより各実施施設に必要部数配布する。各施設で必要情報を記入したシートは、大阪市立大学医学部附属病院 医薬品・食品効能評価センターに送付する。
- 患者識別番号:各施設で重複しない番号を付すものとする。(患者IDでも良い。)
- 登録番号は4桁の整数とし、以下のとおり千の位は施設番号で統一する。各実施施設で、1からの連番を振り、各被験者の登録番号とする。
大阪市立大学病院 1001 ~ 1999
さいがた病院 2001 ~ 2999
九州大学病院 3001 ~ 3999
名古屋大学病院 4001 ~ 4999
注1:登録番号の付与については、各施設に配布する時点で既に施設名と千の位は医薬品・食品効能評価センターにて記入をしているので、3桁の番号を施設担当者にて付与すること。
注2:登録番号の付与に当たっては、必要に応じて各施設にて被験者リストを作成するなど、重複しないように配慮すること。
- データシートに記入する項目は、患者背景(カルテ情報)・唾液アミラーゼである。
- 質問紙(4種類)、アクティグラフの行動記録表
- 個人情報をマスクして(必要情報は、施設名、患者識別番号/登録番号、患者回答日のみ)、コピーをとり、コピーを大阪市立大学医学部附属病院 医薬品・食品効能評価センターへ送付する。
- CES-Dの質問紙は、2部複写になっているので、2枚目をコピーする。
- 電子データのファイル名の入力規則
- 4桁の登録番号を入力して患者データを識別できるようにする。
結果の統計解析について
各検査の感度、特異度を決定。多変量解析により各検査の診断へ寄与する重み付けを決定する。
研究予定期間
2009年12月末:目標数の設定はなし(2010年1月班会議での発表のため)
2010年10月:目標数の最終締め切り
2011年3月:目標数以上のデータ締め切り
資料・検体は以下のスケジュールで送付・郵送のこと。
1回目 2009年12月末
2回目 2010年4月末
3回目 2010年10月末 それ以降は適宜送付
研究予定症例数
大阪市立大学120例(60)、国立病院機構さいがた病院60例(20)、
名古屋大学30例(10)、九州大学30例(10)
(括弧内は同一人物に全ての項目を実施する目標症例数)
個々の被験者の中止・脱落基準
試験責任医師または試験分担医師は、以下に示したいずれかに該当する場合、直ちに中止するよう被験者に連絡を取る。
1)被験者から試験参加の辞退の申し出や同意の撤回があった場合
2)登録後に適格性を満足しないことが判明した場合
3)試験を継続することが被験者の健康を損なうと判断された場合
4)被験者が試験責任医師または分担医師の指示を守れなかったり、予定通り来院しなかったりした場合
5)その他の理由により、試験責任医師が試験を中止することが適当と判断した場合
試験の中止、中断
試験責任医師は、以下の事項に該当する場合は試験実施継続の可否を検討する。
1)検査機器の品質、安全性、有効性に関する重大な情報が得られたとき。
2)倫理委員会により、実施計画書の変更の指示があり、これを受け入れることが困難と判断されたとき。
研究終了後の資料の保存、利用又は廃棄の方法
大阪市立大学病院、九州大学病院、名古屋大学病院、国立病院機構さいがた病院において、収集された資料及び採取された試料は、連結可能匿名化の状態で、個人情報はのぞかれた状態で共同研究機関である大学に運ばれ解析される。試料やそれらに由来する産物などは、被験者の同意があれば、各共同研究施設において、研究期間中、冷凍庫に適切な方法で保管され、研究終了後は破棄される。なお、新たな目的に資料(試料)を用いる場合は、改めてその研究計画を倫理委員会に諮り承認を得たうえで利用する。
研究組織 (個人情報保護のため、報告書には電話.FAX番号、メールアドレスは記載せず)
研究責任者
関西福祉科学大学 健康福祉学部 教授 倉恒弘彦
(大阪市立大学大学院医学研究科 システム神経科学 客員教授)
担当者:中富康仁(大阪市立大学大学院医学研究科 代謝内分泌病態内科学)
〒545-8585 大阪市阿倍野区旭町1-4-3
実施分担者
大阪市立大学大学院医学研究科
代謝内分泌病態内科学 教授 西沢良記
代謝内分泌病態内科学 講師 小山英則
代謝内分泌病態内科学 後期研究医 中富康仁
システム神経科学 学外研究員 山口浩二
COE生体情報解析学 特任講師 福田早苗
東京慈恵会医科大学医学研究科・研究対応部門
ウイルス学 教授 近藤一博
名古屋大学医学部大学院医学系研究科
総合診療医学 教授 伴信太郎
独立行政法人国立病院機構
さいがた病院 院長 下村登規夫
九州大学病院 病院長 久保千春
山口大学大学院医学系研究科
生体情報検査学 教授 野島順三
独立行政法人理化学研究所
分子イメージング科学研究センター センター長
(大阪市立大学大学院医学研究科 システム神経科学 教授) 渡辺恭良
財団法人労働科学研究所
労働衛生学 所長 酒井一博
横浜国立大学大学院
工学研究院 教授 小泉淳一
シスメックス株式会社 主任研究員 大友泰裕
子どもの睡眠と発達医療センター 医長 田島世貴
実施医療機関
(1)大阪市立大学医学部附属病院
倉恒弘彦、山口浩二(担当者・窓口:中富康仁)
〒545-8585 大阪市阿倍野区旭町1-5-7
(2)名古屋大学医学部附属病院
伴信太郎
〒466-8560 名古屋市昭和区鶴舞町65番地
名古屋大学医学部研究棟1号館1階
(3)独立行政法人国立病院機構 さいがた病院
下村登規夫
〒949-3193 上越市大潟区犀潟468‐1
(4)九州大学病院
久保千春
〒812-8582 福岡市東区馬出3-1-1
中央データセンター
大阪市立大学医学部附属病院 医薬品・食品効能評価センター
センター長 西沢良記(担当者・窓口 藤井比佐子)
〒545-8585 大阪市阿倍野区旭町1-2-7
資料・検体郵送先 (情報保護のため、記載せず)
表1 検査項目概要
検査項目 |
データ入力 |
データ取り出し |
サンプル処理 |
送付先 |
備考 |
カルテ情報
|
○ |
× |
× |
大阪市大 |
各施設で記入、コピーを送付 |
唾液 HHV |
× |
× |
○サリベット 遠心・凍結 |
慈恵医大 |
重量測定して、1g未満の場合は再採取 |
アミラーゼ |
○ |
× |
× |
大阪市大 |
ニプロより各施設へ検査機器を提供 |
質問紙 Chalder |
× |
○コピー |
× |
大阪市大 |
コピーを送付 |
VAS |
× |
○コピー |
× |
大阪市大 |
様式をダウンロード コピーを送付 |
CES-D |
× |
○コピー |
× |
大阪市大 |
各施設で購入 コピーを送付 |
きりつ試験 問診票、PS |
× |
○ |
× |
大阪市大 |
CSVファイルを送付 |
自律神経 |
× |
○ |
× |
横浜国大 |
CSVファイルを送付 |
認知課題 単純計算 二重負荷 |
× |
○ ○ |
× |
大阪市大
|
CSVファイルを送付 |
採血 血清 |
× |
× |
○スピッツ・サンプルチューブなど準備・遠心・分注 0.5ml*5本 |
山口大学 サンプルチューブ1本、残りは、各施設で保存 |
クール宅急便・ドライアイス詰めて、-80度保存が望ましいが、-20度でも可 |
血漿 |
|
|
○スピッツ・サンプルチューブ準備・遠心・分注・保存 0.5ml*5本 |
各施設で保存 |
-80度保存が望ましいが、-20度でも可 |
RNA
|
× |
× |
2.5ml*4本 |
シスメックス 慈恵医大 |
スピッツはシスメックスが用意 |
アクティグラフ |
× |
○ ○コピー |
× |
大阪市大 |
72時間 0クロッシング法、電子ファイル 行動記録表のコピー |
表2 各施設のルーチン作業
項目 |
小項目 |
処理 |
送付先 |
送付 (1回目) |
送付 (2回目) |
送付 (3回目) |
同意書 |
|
同意書を取得する(複数ある場合はすべて) |
施設で保管 |
2009年12月末 |
2010年4月末 |
2010年10月末 |
唾液 |
HHV |
遠心分離à送付時まで-80度保管 |
慈恵医大 近藤先生 (送付前に連絡を取ること) |
|||
アミラーゼ |
データは表示されるだけで記録されないので、データシートに記入 |
大阪市大評価センター |
||||
質問紙 |
Chalder |
コピーをとってコピーを送付 |
大阪市大評価センター |
|||
VAS |
コピーをとってコピーを送付 |
大阪市大評価センター |
||||
CES-D |
2部複写の2枚目のコピーをとってコピーを送付 |
大阪市大評価センター |
||||
きりつ名人 |
疲労質問票・PS |
Csvデータにて取り出し |
大阪市大評価センター |
|||
きりつ試験 |
Csvデータにて取り出し |
横浜国大 小泉先生 (送付前に連絡を取ること) |
||||
認知課題 |
単純計算課題 |
Csvデータにて取り出し |
大阪市大評価センター |
|||
二重負荷試験 |
Csvデータにて取り出し |
大阪市大評価センター |
||||
採血 |
血清0.5ml×5本
|
0.5ml×5本に分注する |
1本 山口大学 野島先生 (送付前に連絡を取ること) |
|||
4本 施設で保管 |
||||||
血漿0.5ml×5本 |
0.5ml×5本に分注する |
施設で保管 |
||||
RNA 2.5ml×4本
|
2.5ml×4本に分注する |
3本 シスメックス㈱ 大友氏 (送付前に連絡を取ること) |
||||
1本 慈恵医大 近藤先生 (送付前に連絡を取ること) |
||||||
アクティグラフ |
データ |
電子データにて取り出し |
大阪市大評価センター |
|||
行動記録表 |
コピーをとってコピーを送付 |
大阪市大評価センター |
||||
データシート |
データシート |
記入漏れがないことを確認した後、原本を送付 |
大阪市大評価センター |
|||
チェックリスト |
記入漏れがないことを確認した後、原本を送付 |
大阪市大評価センター |
図1 体制イメージ図